| Chemie |
||||||
 |
||||||
| Was Schüler im Chemieunterricht gerne verstehen würden, aber ihren Chemielehrer nicht (mehr) zu fragen wagen ... |
Archiv I
Fragen/Antworten 22.04.97-22.06.97
|
|||
| Weitere Recherchen - auch im
Internet - brachten Null Ergebnis. Zur Tollens- (Silberspiegel-)Reaktion
habe ich allerdings einen Mechanismus gefunden, der aber ausdrücklich
als "möglich" gekennzeichnet war. Diesen Mechanismus habe
ich mal sinngemäß auf die Fehling-Reaktion übertragen, d. h. der folgende
Mechanismus ist reichlich spekulativ. Wer mehr darüber weiß, möge mir
bitte eine email schicken!
Also: Die Fehling-Lösung enthält bekanntlich einen Komplex von Cu2+ mit Tartrat- (d. h. Weinsäure-)Ionen, in dem Cu2+ gegen Ausfällung zu Cu(OH)2 geschützt ist. Das später entstehende Cu+ bildet mit Tartrat-Ionen keinen Komplex, so daß Cu2O ausfallen kann (rote/gelbrote Farbe). Erste Schritte: |
|
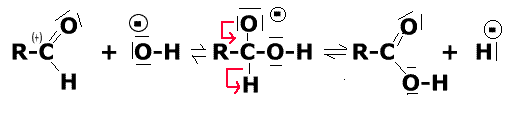 |
| Es entsteht also durch den nucleophilen Angriff von OH- ein negatives H-Ion (Hydrid-Ion); die Elektronen stammen von C, das dadurch oxidiert wird (die Elektronen, die die OH-Gruppe binden, werden nämlich aufgrund der höheren EN des O-Atoms diesem zugerechnet). | Dieses negative H-Ion überträgt die
Elektronen auf Cu2+: H|- + 2 Cu2+ ---> H+ + 2Cu+ Jetzt werden noch drei OH- Ionen verbraucht, wobei zwei H2O-Moleküle und das rote Cu-I-Oxid entstehen: |
| H+ + OH- ergibt H2O 2 Cu+ + OH- ergibt 2 Cu+ + O2- (rot) und H+ H+ + OH- ergibt H2O |
Zusammengefaßte Gesamtgleichung: R-CHO + 2 Cu2+ + 4 OH- ergibt R-COOH + 2Cu+ + O2- + 2 H2O Wie gesagt, der Mechanismus ist reichlich spekulativ! |
Nehmen wir also Benzol: Das Molekül ist topfeben. |
|
| Jedes C-Atom besitzt nach den drei Einfach- (sigma-)Bindungen noch ein freies p(z)-Orbital. Diese p-Orbitale sind somit gleich weit voneinander entfernt; aus der Sicht eines einzelnen p-Orbitals sind die beiden Nachbar-p-Orbitale also völlig gleichberechtigt. Wie soll es sich entscheiden - mit dem linken Nachbarn verschmelzen ("überlappen") oder mit dem rechten? Für Orbitale keine Frage der Intelligenz oder Willkür - die Entscheidung erfolgt ausschließlich unter einem Gesichtspunkt: der energetisch niedrigste Zustand muß es sein! Und unter diesem Gesichtspunkt ist es am besten, mit beiden Nachbar-p-Orbitalen zu verschmelzen! Wenn das alle sechs p-Orbitale so sehen (und das tun sie!), dann entsteht eine ringförmig geschlossene Elektronenwolke, in der sich die einzelnen p-Elektronen (die man jetzt pi-Elektronen nennt) völlig | |
| frei bewegen können. Man nennt das "delokalisiert", d. h. in ihrem Aufenthaltsort nicht mehr auf den Raum zwischen zwei C-Atomen beschränkt. Und warum nun ist das der energetisch niedrigste Zustand? Vereinfacht gesagt: Weil die Elektronen nicht mehr in abgegrenzten "Gefängniszellen" (=lokalisierte Doppelbindungen) eingesperrt sind, sondern viele mögliche Aufenthaltsorte haben - eben delokalisiert sind.Man nennt die dadurch entstandene gleichmäßige Verteilung auch "Unordnung", und danach "strebt" nun mal jedes System, wenn man es läßt. Überlege mal, wie es in deinem Zimmer zuhause aussehen würde, wenn du es "läßt", d. h. nicht aufräumst: Völlig gleichmäßige Verteilung von Büchern, CDs, Hemden, Kugelschreibern etc. im ganzen Raum - eine sagenhafte Unordnung! So wollen es auch die Elektronen gerne haben. |
| Der - rein theoretische - Energieunterschied zwischen der "geordneten" Struktur des Benzols mit drei Doppel- und drei Einfachbindungen (die es ja gar nicht gibt!) und der tatsächlich vorhandenen "ungeordneten" Struktur mit dem Ring der pi-Elektronen wird Mesomerie-Energie genannt.Und da schließt sich gleich noch eine Überlegung an: Der Chemiker ist an und für sich ein ordentlicher Mensch. Er möchte gerne eindeutige Formeln malen, in denen ganz klar ist, was sich einfach, doppelt oder dreifach bindet. Und jetzt dieser entsetzlich unordentliche Zustand mit den sechs frei beweglichen pi-Elektronen des Benzols! Wie um Himmels willen das in einer Formel ausdrücken?! |
| Doch der Chemiker ist nicht nur ordentlich, sondern auch erfinderisch: Benzol könnte nämlich, wie wir wissen, drei Doppelbindungen und drei Einfachbindungen haben (hat es aber nicht, wie wir ebenfalls wissen!). Die Formel wäre | 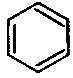 |
| Hier hätten sich die p-Orbitale - sagen wir mal - für die Überlappung nach rechts entschieden. Wenn sie sich für die Überlappung nach links entschieden hätten, wäre die Formel | 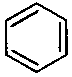 |
| Wohlgemerkt, diese beiden Formeln sind rein theoretisch, denn die p-Orbitale tun weder das eine noch das andere. Aber man sieht so schön die gewohnten Doppel- und Einfachbindungen!! | Aber was die p-Orbitale wirklich tun, sich nämlich nach links und nach rechts entscheiden, liegt ziemlich in der Mitte zwischen den beiden formelmäßig dargestellten rein theoretischen Möglichkeiten! |
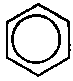
| Der Chemiker bezeichnet also diese beiden rein theoretischen, praktisch nicht zutreffenden, aber der Gewohnheit entsprechenden Strukturen als Grenzstrukturen und kann sich jetzt die tatsächliche Struktur als Mischung daraus vorstellen: | ||
 |
 |
 |
| Gibt es nicht! Sieht aber ordentlich (wie gewohnt) aus! Grenzstruktur 1 |
Das gibt es wirklich; der Kreis ist der mühselige Versuch, die Delokalisierung der pi-Elektronen formelmäßig darzustellen. Dies ist also die tatsächlich vorhandene "Mischung" der beiden rein theoretischen "Grenzstrukturen".
|
Gibt es nicht! Sieht aber ordentlich (wie gewohnt) aus! Grenzstruktur 2 |
Eine schwierige Frage, was das praktisch für unsere Gesundheit bedeutet. Man darf nicht vergessen, daß solche trans-Fettsäuren durchaus auch in natürlichen Produkten wie z. B. Butter vorkommen (aber nicht sehr häufig). Zum anderen ist der Einsatz von trans-Fettsäuren in den USA - wo die Diskussion ihren Ausgangspunkt nahm - erheblich stärker als bei uns. Bei Tierversuchen mit einem erheblichen Anteil von trans-Fettsäuren im Futter wurden Veränderungen in der Fettsäurezusammensetzung am Herzen festgestellt. Es deutet einiges darauf hin, daß die Gefahr hoher Bluttfettwerte durch hohe Dosen von trans-Fettsäuren steigt. Derzeit scheint in Deutschland jedenfalls keine akute Gefährdung zu bestehen. Da ich aber kein Mediziner bin, möchte ich anstelle weiterer Ausführungen auf die zahlreichen Internet-Veröffentlichungen zu diesem Thema verweisen. |
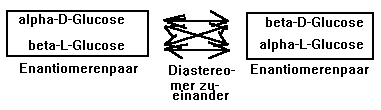
Im Spiegelbild sind nun aber auch die OH-Gruppen an den anderen asymmetrischen C-Atomen vertauscht, also bei Glucose an C2, C3 und C4. Also wenn die Anordnung (Konfiguration) in der Fischer-Projektion vom zweiten bis zum fünften C-Atom rechts-links-rechts-rechts lautet (kennst du die "ta-tü-ta-ta"-Regel?), dann ist das die D-Glucose. Wenn sie aber links-rechts-links-links lautet, dann ist das die L-Glucose (obwohl die Benennung formal nur am letzten - fünften - asymm. C-Atom festgemacht ist, sind - wie man sieht - auch die anderen OH-Gruppen jeweils "andersrum"). Deshalb hat diese Benennung D oder L auch in der Ringform ihren Sinn, denn vom zweiten bis zum vierten (asymm.) C-Atom verschwindet die OH-Gruppe ja nicht! Wenn das anders wäre, dann wäre es nicht mehr Glucose, sondern ein anderer Zucker. Man spricht dann von Diastereomeren - da sind dann die Atomabstände verschieden, während sie bei den Enantiomeren(paaren) völlig identisch sind. |
 |
| Zur Übung möchte ich dir die Seite "Kohlenhydrate/Carbohydrates" empfehlen; dieses Bild ist dort als Lösung einer Aufgabe enthalten. Einfach unten anklicken! |
Man kann sagen, Kupfer reagiert mit Sauerstoff zu Kupferoxid. Das ist zunächst eine Wortgleichung. In die Sprache der Chemie übersetzt lautet das 2 Cu + O2 ------>2 CuO und ist eine Reaktionsgleichung. Die Bedeutung: Erstens, es reagieren zwei mol Cu-Atome mit einem mol Sauerstoffmolekülen zu zwei mol der "Formeleinheit" CuO (Formeleinheit deshalb, weil die Verbindung CuO als Ionengitter vorliegt, in dem sehr viele Cu2+-Ionen auf genausoviele O2--Ionen kommen, das Verhältnis Cu : O also 1 : 1 ist; Moleküle gibt's hier nicht). Ein mol bezeichnet übrigens eine bestimmte, sehr große Teilchenzahl, nämlich 6 x 1023. Das wäre also die Bedeutung einer Stoffgleichung. Zweitens kann man sagen, es reagieren zwei Cu-Atome mit einem Molekül Sauerstoff zu zwei Cu2+-Ionen und zwei O2--Ionen. Dann schreibt man aber besser die Sache auch so hin: 2 Cu + O2 -------->2 Cu2+ + 2 O2- Das wäre jetzt die Bedeutung einer Teilchengleichung. Haarspalterisch, nicht wahr? Aber schauen wir uns ein anderes Beispiel an: Salzsäure reagiert mit Natriumhydroxid zu Natriumchlorid und Wasser. Die Reaktionsgleichung als Stoffgleichung: HCl + NaOH ---------> NaCl + H2O Und jetzt die Reaktionsgleichung als Teilchengleichung: H3O+ + Cl- + Na+ + OH- --------> 2 H2O + Na+ + Cl- Da Salzsäure die wässr. Lösung von HCl ist, liegt also das Teilchen H3O+ vor. Und was viel wichtiger ist: Erst in dieser Schreibweise erkennt man so richtig, daß im Grunde nur zwei Teilchen miteinander reagieren, während die Na- und Cl-Ionen unverändert bleiben (NaCl ist nämlich eine Ionenverbindung - aus Metall- und Nichtmetallionen)! Man kann also auch einfacher schreiben H3O+ + OH- ------------> 2 H2O Du siehst, auch Teilchengleichungen können ihren Sinn haben. Viel mehr noch gilt das für komplizierte Redoxgleichungen. Aber damit will ich jetzt lieber nicht anfangen ... Wie gesagt, ich bin mir nicht ganz sicher, diese Frage vorkenntnisgemäß beantwortet zu haben. Wenn nicht, bitte die Frage nochmal mit zusätzlichen Erläuterungen stellen! |
Normalerweise leitet man das MWG so ab: Im Gleichgewicht der Reaktion aA + bB <=> cC + dD gilt vhin = vzurück , also Die Geschwindigkeitskonstanten khin und kzurück hängen für eine gegebene Reaktion tatsächlich nur von der Temperatur ab: Mit welcher Energie und wie häufig die Teilchen aufeinander treffen, ergibt sich aus der Geschwindigkeitsverteilung und der Bewegungsenergie - beide werden nach Gleichungen berechnet, die - wie gesagt, für eine bestimmte Reaktion - als einzige veränderliche Größe die Temperatur enthalten. Weitere Größen, die noch eine Rolle spielen, sind z. B. die Gaskonstante R, die Masse der Teilchen, die Aktivierungsenergie der Reaktion und ein sterischer Faktor (gibt grob gesagt an, in welcher Orientierung die Teilchen aufeinanderprallen müssen, damit es klappt). Diese weiteren Größen sind alle von der Temperatur unabhängig. Damit ist also K für eine gegebene Reaktion nur von der Temperatur unabhängig. Das Problem bei dieser Herleitung ist nur die Verwendung der stöchiometrischen Größe: vhin muß nämlich im konkreten Fall gar nicht gleich khin * ca(A)*cb(B) sein, und vzurück muß auch nicht gleich kzurück * cc(C)*cd(D) sein. Das hängt nämlich nicht von der Stöchiometrie aA + bB <=> cC + dD ab, sondern vom jeweils langsamsten und damit geschwindigkeitsbestimmenden Teilschritt der Reaktion. vhin könnte also in unserem Fall auch gleich khin*c2(A) sein, wenn nämlich im langsamsten Teilschritt der Hinreaktion zwei Teilchen A zusammenstoßen. Ebenso könnte vzurück z. B. auch gleich kzurück*c1(C)*c2(D) sein, wenn nämlich im langsamsten Teilschritt der Rückreaktion ein Teilchen C mit zwei Teilchen D zusammentrifft. Und deshalb stimmt die Herleitung des MWG mit den stöchiometrischen Größen, wie sie in der Reaktionsgleichung stehen, eben nicht (das so ermittelte MWG stimmt aber trotzdem!). (Anmerkung: Siehe Zusatzfrage weiter unten!) Um exakt zu sein, muß man die "Triebkraft" der Hin- und Rückreaktion betrachten. Diese Triebkraft wird in der sogenannten "freien Enthalpie" ^G ausgedrückt. Diese hängt ihrerseits von der Reaktionsenthalpie ^ H und dem Ausdruck T* ^S ab, d.h. "Temperatur mal Änderung der Energie, die in der Unordnung steckt (=Entropie))". Die einzige veränderliche Größe ist auch hier die Temperatur T. Wenn Triebkraft hin = Triebkraft zurück ist, dann hat sich das chem. Gleichgewicht eingestellt und K seinen Tabellenwert erreicht. Zu dieser Thematik gibt es inzwischen hervorragende Darstellungen in Schulbüchern, weshalb ich hier nicht weiter ins Detail gehen will. |
Das Gibbs-Helmholtz-Gesetz sagt aus (Delta)G, die "freie Enthalpie", ist die Triebkraft der Reaktion, oder anders gesagt, der "arbeitsfähige Teil" der Reaktionswärme. Nun ist sowohl (Delta)H als auch (Delta)S fast unabhängig von der Reaktionstemperatur
T. Der Zusammenhang mit der MWG-Konstanten K: ln K = - 1/(R*T) * (Delta)G Was hat das Ganze mit den Konzentrationen zu tun? Die Unordnung (Entropie) S eines Stoffes nimmt ab bei zunehmender Konzentration und sie nimmt zu bei abnehmender Konzentration. Wenn also im Verlauf einer Reaktion die Konzentration des Ausgangsstoffs (Edukts) geringer wird, steigt hier die Unordnung. Mit zunehmender Unordnung fühlt sich das System aber immer wohler, d.h. die aus der Entropie resultierende "Triebkraft" für die Hinreaktion sinkt. Gleichzeitig wird aber die Konzentration des Produkts immer grösser, d. h. hier sinkt die Unordnung. Da fühlt sich das System aber nicht wohl, die aus der Entropie resultierende "Triebkraft" für die Rückreaktion steigt also. Irgendwann ist also das Gesamt-Delta-S des Reaktionssystems gleich Null (weil Delta-S-Hinreaktion und Delta-S-Rückreaktion verschiedene Vorzeichen haben). Genauso gilt: Wenn die Konzentration des Ausgangsstoffs geringer wird, sinkt der Betrag der Reaktionswärme Delta-H der Hinreaktion. Gleichzeitig steigt die Konzentration des Produkts, es steigt also auch der Betrag der Reaktionswärme Delta-H der Rückreaktion. Da sich die Reaktionswärmen Delta-H der Hin- und Rückreaktion in ihrem Vorzeichen unterscheiden, ist also irgendwann das Gesamt-Delta-H des Reaktionssystems gleich Null. Und so kann man ausrechnen, dass "irgendwann" die "Triebkräfte" Delta-G für die Hin- und für die Rückreaktion (die ebenfalls verschiedene Vorzeichen haben) gleich groß sind - Gesamt-Delta-G der Reaktion also gleich Null - keine "Gesamt-Triebkraft" mehr - Gleichgewicht! |
Falls - bei "Seiteneinsteigern", die nicht über die Homepage gekommen sind - der Navigationsbalken mit dem Inhaltsverzeichnis nicht zu sehen ist: